ANSM - Mis à jour le : 06/03/2023
OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusionComplexe prothrombique humain Veuillez lire attentivement cette notice avant d'utiliser ce médicament car elle contient des informations importantes pour vous.·Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d'autres personnes. II pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
·Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusion ?
3. Comment utiliser OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusion ?
6. Contenu de l'emballage et autres informations.
OCTAPLEX est utilisé pour traiter et prévenir les saignements :
·provoqués par des médicaments appelés anti-vitamine K (comme la Warfarine). Ces médicaments bloquent l'effet de la vitamine K et entraînent une diminution des facteurs de coagulation vitamine K dépendants dans votre organisme. OCTAPLEX est utilisé quand une correction rapide de cette diminution est nécessaire.
·chez les personnes nées avec un déficit en facteurs de coagulation vitamine K dépendants II et X et est utilisé dans le cas où aucun facteur de coagulation spécifique de haute pureté n'est disponible.
N'utilisez jamais OCTAPLEX :·Prenez conseil auprès d'un médecin spécialiste des troubles de la coagulation lorsque vous recevez OCTAPLEX
·Si vous présentez un déficit acquis en facteurs de coagulation vitamine K dépendants (induit par les antivitamines K par exemple). OCTAPLEX doit être administré uniquement lorsqu'une correction rapide de la diminution du taux de facteurs de coagulation vitamine K dépendants est requise, par exemple en cas d'hémorragie majeure ou d'urgence chirurgicale. Dans les autres cas, la diminution de la posologie des antivitamines K et/ou l'administration de vitamine K est généralement suffisante.
·Si vous êtes traité par un antagoniste de la vitamine K (comme la warfarine), vous avez un risque élevé de formation de caillots dans le sang. Dans ce cas, le traitement par OCTAPLEX peut augmenter ce risque.
·Si vous êtes né avec un déficit héréditaire de l'un des facteurs vitamine K dépendants, le facteur de coagulation spécifique doit être utilisé quand il est disponible.
·En cas de réaction allergique ou de type anaphylactique, votre médecin arrêtera immédiatement la perfusion et vous donnera un traitement approprié.
·Il existe un risque de thrombose ou de coagulation intravasculaire disséminée (maladie grave entraînant la formation de caillots de sang dans tout l'organisme) si vous êtes traité par OCTAPLEX (notamment si vous le recevez régulièrement). Vous devez être étroitement surveillé pour détecter les signes ou symptômes évocateurs d'une coagulation intravasculaire disséminée ou d'une thrombose.
·Ceci est particulièrement important si vous présentez des antécédents de maladie coronarienne, une maladie hépatique, si vous allez subir une opération et également lorsque OCTAPLEX est administré aux nouveau-nés.
·Aucune donnée n'est disponible sur l'utilisation d'OCTAPLEX lors de saignement périnatal faisant suite à un déficit en vitamine K chez le nouveau-né.
·Ce médicament contient de I'héparine et peut provoquer des réactions allergiques et une baisse du nombre de cellules sanguines, pouvant influer sur la coagulation.
·Ce médicament contient du sodium. Ce médicament contient 75 ‑ 125 mg de sodium par flacon de 500 UI.
·A prendre en compte chez les patients contrôlant leur apport alimentaire en sodium.
Sécurité virale :·Lorsque des médicaments sont préparés à partir de sang ou de plasma humain, des mesures sont mises en place afin de prévenir le risque de transmission d'infection aux patients. Celles-ci comprennent une sélection rigoureuse des donneurs de sang et plasma afin d'exclure tout risque d'infection et la réalisation de tests de dépistage des marqueurs viraux/d'infection sur chaque don et sur les mélanges de plasma.
·Les fabricants de ces produits incluent également dans le traitement du sang ou du plasma, des étapes capables d'éliminer et/ou d'inactiver les virus. Malgré ces mesures, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut être totalement exclu. Ceci s'applique également à des agents viraux inconnus ou émergents ou à d'autres types d'agents infectieux.
·Ces mesures sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le virus de l'immunodéficience humaine (VIH), le virus de l'hépatite B (VHB) et le virus de l'hépatite C (VHC). Les mesures prises peuvent être d'efficacité limitée vis-à-vis des virus non enveloppés tels que le virus de l'hépatite A (VHA) et le parvovirus B19. L'infection par le parvovirus B19 peut être sévère chez la femme enceinte (avec infection du ftus) et chez les personnes dont le système immunitaire est déficient ou atteints de certains types d'anémie (par exemple l'anémie hémolytique ou la drépanocytose).
·Une vaccination appropriée (hépatite A et B) vous est recommandée si vous recevez du complexe prothrombique dérivé du plasma humain de façon régulière/répétée.
Enfants et adolescentsAucune donnée n'est disponible concernant l'utilisation d'OCTAPLEX chez les enfants et les adolescents.
Autres médicaments et OCTAPLEXOCTAPLEX ne doit pas être mélangé à d'autres médicaments.
OCTAPLEX arrête l'effet des médicaments antagonistes de la vitamine K (comme la Warfarine) mais aucune interaction avec d'autres médicaments n'est connue.
OCTAPLEX peut impacter les résultats des tests de coagulation sensibles à l'héparine.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusion avec des aliments et boissonsSans objet.
Grossesse et allaitementOCTAPLEX ne doit être utilisé pendant la grossesse ou l'allaitement qu'en cas de nécessité absolue.
Demandez conseil à votre médecin et à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machinesLes effets d'OCTAPLEX concernant l'aptitude à conduire des véhicules ou à utiliser des machines ne sont pas connus.
OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusion contient du sodium.L'héparine peut provoquer des réactions allergiques et diminuer le nombre de cellules sanguines risquant ainsi d'affecter le système de coagulation du sang. Les patients ayant des antécédents de réactions allergiques induites par l'héparine doivent éviter d'utiliser des médicaments contenant de l'héparine.
Ce médicament contient 75 125 mg de sodium (composant principal du sel de cuisine/table) par flacon (flacon de 500 UI). Cela équivaut à 3,8 6,3 % de l'apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
3. COMMENT UTILISER OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusion ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Le traitement par OCTAPLEX doit être initié sous la surveillance d'un médecin spécialiste des troubles de la coagulation.
Dans un premier temps, la solution est dissoute dans de l'eau ;
Puis, la solution est administrée dans une veine (voie intraveineuse).
La posologie et la durée du traitement dépendent :
En cas de surdosage il y a un risque plus élevé de développer :
·des complications de la coagulation (par exemple, une attaque cardiaque et la formation de caillots dans vos veines ou vos poumons),
·une coagulation intravasculaire disséminée (une maladie grave entraînant la formation de caillots de sang dans tout l'organisme).
Si vous oubliez d'utiliser OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusionSans objet.
Si vous oubliez d'utiliser OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusionSans objet.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Fréquent (peut toucher jusqu'à 1 personne sur 10)Caillots dans les vaisseaux sanguins.
Peu fréquent (peut toucher jusqu'à 1 personne sur 100)Anxiété, augmentation de la pression artérielle, symptômes semblables à de l'asthme, toux avec crachats de sang, saignement de nez, brûlures au site d'injection, caillots dans le dispositif.
Rare (peut toucher jusqu'à 1 personne sur 1 000)Des réactions de type allergique peuvent survenir. Une élévation transitoire des résultats des tests hépatiques (transaminases) a été observée dans de rares cas.
Les patients traités par OCTAPLEX pour un traitement de substitution peuvent développer des anticorps neutralisants (inhibiteurs) dirigés contre n'importe quel facteur de coagulation du complexe prothrombique. Si de tels inhibiteurs apparaissent, le traitement de substitution ne sera pas très efficace.
Très rare (peut toucher jusqu'à 1 personne sur 10 000)Une augmentation de la température corporelle (fièvre) a été observée.
Il y a un risque de coagulation sanguine après administration de ce médicament.
Fréquence indéterminé (ne peut être estimée sur la base des données disponibles)Grave réaction allergique et choc allergique, hypersensibilité, tremblements, insuffisance cardiaque, augmentation du rythme cardiaque, insuffisance circulatoire, chute de la tension artérielle, insuffisance respiratoire, difficultés à respirer, nausées, urticaire, éruption cutanée (rash), frissons.
L'héparine contenue dans la préparation peut provoquer une diminution soudaine du nombre de plaquettes dans le sang. C'est une réaction allergique appelée « thrombocytopénie de type II induite par l'héparine ». Dans de rares cas, chez des patients sans antécédents d'hypersensibilité à l'héparine, la diminution du nombre de plaquettes peut survenir 6 à 14 jours après le début du traitement. Chez les patients ayant des antécédents d'hypersensibilité à l'héparine, cette diminution peut survenir quelques heures après le début du traitement.
Le traitement avec OCTAPLEX doit être immédiatement interrompu chez les patients présentant cette réaction allergique. Ces patients ne devront plus recevoir des médicaments contenant de l'héparine à l'avenir.
Pour toute information sur la sécurité virale, voir la section 2.
Déclaration des effets secondairesSi vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d'informations sur la sécurité du médicament.
5. COMMENT CONSERVER OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusion ?
Tenir hors de la vue et de la portée des enfants.
N'utilisez pas ce médicament après la date de péremption indiquée sur l'étiquette. La date de péremption fait référence au dernier jour de ce mois.
La poudre ne doit être dissoute qu'immédiatement avant l'injection. La stabilité de la solution a été démontrée pendant un maximum de 8 heures à une température comprise +25°C. Afin d'éviter toute contamination, la solution doit toutefois être utilisée immédiatement et une seule fois.
Ne jetez aucun médicament au tout à l'égout ni avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L'EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient OCTAPLEX 500 UI, poudre et solvant pour solution pour perfusion
·Les substances actives sont :
|
Nom du constituant |
OCTAPLEX Quantité par flacon de 20 mL |
OCTAPLEX Quantité par mL de solution reconstituée |
|
Protéines totales |
260 ‑ 820 mg |
13 ‑ 41 mg/mL |
|
Facteur II de coagulation humain |
280 ‑ 760 UI |
14 ‑ 38 UI/mL |
|
Facteur VII de coagulation humain |
180 ‑ 480 UI |
9 ‑ 24 UI/mL |
|
Facteur IX de coagulation humain |
500 UI |
25 UI/mL |
|
Facteur X de coagulation humain |
360 ‑ 600 UI |
18 ‑ 30 UI/mL |
|
Protéine C |
260 ‑ 620 UI |
13 ‑ 31 UI/mL |
|
Protéine S |
240 ‑ 640 UI |
12 ‑ 32 UI/mL |
L'activité spécifique du produit est ≥ 0,6 UI/mg, exprimée en activité du facteur IX.
Héparine, citrate de sodium dihydraté, eau pour préparations injectables.
OCTAPLEX se présente sous la forme d'une poudre et d'un solvant pour solution pour perfusion. La poudre est hygroscopique, blanche ou légèrement colorée ou se présente sous la forme d'un solide friable contenu dans un flacon en verre. Le solvant est de l'eau pour préparations injectables et est fourni dans un flacon en verre. La solution reconstituée est claire ou légèrement opalescente et peut être colorée.
OCTAPLEX contient :
·1 dispositif de transfert Nextaro®
Titulaire de l'autorisation de mise sur le marché
OCTAPHARMA France62 BIS AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
FRANCE
Exploitant de l'autorisation de mise sur le marché
OCTAPHARMA France62 BIS AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
FRANCE
OCTAPHARMA PHARMAZEUTIKA PRODUKTIONSGES m.b.HOBERLAAER STRASSE 235
1100 VIENNE
AUTRICHE
ou
OCTAPHARMA SAS70-72, RUE DU MARECHAL FOCH
67380 LINGOLSHEIM
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l'ANSM (France).
Informations réservées aux professionnels de santé
Les informations suivantes sont destinées exclusivement aux professionnels de santé :Les informations générales sur l'utilisation d'OCTAPLEX sont décrites en section 3.
Instructions pour le traitement
Lire toutes les instructions et les suivre scrupuleusement.
Durant la procédure décrite ci-dessous, l'asepsie doit être maintenue.
Le produit se reconstitue rapidement à température ambiante.
La solution doit être limpide ou légèrement opalescente. Ne pas utiliser de solution trouble ou présentant un dépôt. Les produits reconstitués doivent être inspectés visuellement, pour mettre en évidence la présence de particules et un changement de coloration avant administration.
Après reconstitution, la solution doit être utilisée immédiatement.Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.Posologie
Saignements et prophylaxie péri-opératoire des accidents hémorragiques lors d'un traitement par anti-vitamines K :
La dose nécessaire dépend de l'INR déterminé avant le traitement et de l'INR cible. Le tableau suivant donne les doses approximatives (mL de produit reconstitué/kg de poids corporel) nécessaires pour normaliser l'INR (≤ 1,2 en 1 heure) en fonction de l'INR initial.
|
INR initial |
2 ‑ 2,5 |
2,5 ‑ 3 |
3 ‑ 3,5 |
> 3,5 |
|
Dose approximative* (mL OCTAPLEX/kg de poids corporel) |
0,9 ‑ 1,3 |
1,3 ‑ 1,6 |
1,6 ‑ 1,9 |
> 1,9 |
* Une dose unique ne doit pas dépasser 3000 UI (120 mL d'OCTAPLEX).
Comme ces recommandations sont empiriques et que le taux de récupération et la durée de l'effet peuvent varier, le suivi de l'INR durant le traitement est obligatoire.
Saignements et prophylaxie péri-opératoire lors de déficit congénital des facteurs de coagulation vitamine K dépendants II et X, lorsque aucun facteur de coagulation spécifique n'est disponible :
Le calcul de la posologie pour un traitement repose sur les notions empiriques suivantes :
Approximativement 1 UI de facteur II ou X par kg de poids corporel élève l'activité plasmatique des facteurs II et X de 0,02 et 0.017 UI/mL respectivement.
Unités requises = poids corporel (kg) x augmentation souhaitée en Facteur X (UI/mL) x 60
où 60 (mL/kg) correspond à l'inverse du taux de récupération estimé.
Posologie requise pour le facteur II:
Unités requises = poids corporel (kg) x augmentation souhaitée en facteur II (UI/mL) x 50
Si le taux de récupération individuel est connu, cette valeur doit être utilisée pour le calcul.
Instructions pour la reconstitution :
|
|
1. Si nécessaire, amenez le solvant (eau pour préparations injectables) et la poudre, dans les flacons fermés, à température ambiante. Cette température doit être maintenue pendant la reconstitution. Si un bain-marie est utilisé pour chauffer, une attention doit être portée pour que l'eau nentre pas en contact avec les bouchons en caoutchouc ou les opercules des flacons. La température du bain-marie ne doit pas dépasser 37 °C. 2. Retirez les opercules détachables du flacon de poudre et du flacon de solvant et désinfectez les bouchons en caoutchouc de façon appropriée. 3. Retirez le couvercle de l'emballage externe du Nextaro®. Sans retirer l'emballage externe, placez le flacon de solvant sur une surface plane et le tenir fermement. Placez la partie bleue du Nextaro® sur le dessus du flacon de solvant et appuyez fermement jusqu'à ce qu'il s'enclenche (Fig. 1). N'effectuez pas de rotation lors de la fixation ! Tout en maintenant le flacon de solvant, retirez soigneusement l'emballage externe du Nextaro® ; attention à bien laisser le Nextaro® fermement fixé au flacon de solvant (Fig. 2). |
|
|
4. Placez le flacon de poudre sur une surface plane et le tenir fermement. Prenez le flacon de solvant avec le Nextaro® fixé et le retourner. Placez la partie blanche du connecteur Nextaro® sur le dessus du flacon de poudre et appuyer fermement jusqu'à ce qu'il s'enclenche (Fig. 3). N'effectuez pas de rotation lors de la fixation ! Le solvant s'écoule automatiquement dans le flacon de poudre. |
|
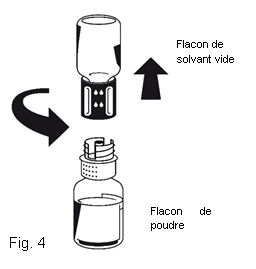
5. Les deux flacons toujours fixés, tournez doucement le flacon de poudre jusqu'à ce que le produit soit dissous. OCTAPLEX se dissout rapidement à température ambiante pour donner une solution incolore à légèrement bleue. Dévissez le Nextaro® en deux parties (Fig. 4). Eliminez le flacon de solvant vide avec la partie bleue du Nextaro®. |
 Si la poudre ne se dissout pas complètement ou si un agrégat s'est formé, ne pas utiliser la solution.
Si la poudre ne se dissout pas complètement ou si un agrégat s'est formé, ne pas utiliser la solution.
Instructions pour la perfusion
Par précaution, le pouls du patient doit être pris avant et pendant la perfusion. En cas d'augmentation nette du pouls, la vitesse de perfusion doit être réduite ou l'administration doit être interrompue.
1. Fixez une seringue de 20 mL (pour 500 UI) à la partie blanche du Nextaro®. Retournez le flacon et prélevez la solution dans la seringue.
Dès que la solution a été transférée, tenez fermement le piston de la seringue (en la tenant tournée vers le bas) et retirez la seringue du Nextaro®. Eliminez le Nextaro® et le flacon vide.
2. Désinfectez le site d'injection avec une compresse imbibée d'alcool.
3. Injectez lentement la solution par voie intraveineuse avec un débit réduit : initialement 1 mL par minute, pas plus de 2 à 3 mL par minute.
Du sang ne doit pas refluer dans la seringue en raison du risque de formation de caillots de fibrine. Le Nextaro® est réservé à un usage unique.