ANSM - Mis à jour le : 28/09/2006
KASKADIL, poudre et solvant pour solution injectable
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
Dans cette notice :
1. QU'EST-CE QUE KASKADIL, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER KASKADIL, poudre et solvant pour solution injectable ?
3. COMMENT UTILISER KASKADIL, poudre et solvant pour solution injectable ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER KASKADIL, poudre et solvant pour solution injectable ?
6. INFORMATIONS SUPPLEMENTAIRES
KASKADIL est l'association de quatre facteurs de la coagulation: facteur II, VII, IX, X.
KASKADIL est indiqué dans:
KASKADIL n'est pas indiqué dans la maladie hémorragique du nouveau-né (déficit en vitamine K).
Liste des informations nécessaires avant la prise du médicament
Sans objet.
N'utilisez jamais KASKADIL, poudre et solvant pour solution injectable dans les cas suivants:
Précautions d'emploi ; mises en garde spéciales
Faites attention avec KASKADIL, poudre et solvant pour solution injectable:
·Le risque de transmission d'agents infectieux ne peut pas être définitivement exclu lorsque sont administrés des médicaments préparés à partir de sang ou de plasma humain.
Ceci s'applique également à des agents qui pourraient engendrer une maladie et dont la nature est jusqu'ici inconnue.
Ce risque est cependant limité par:
L'efficacité de l'élimination et/ou de l'inactivation virale reste cependant limitée vis-à-vis de certains virus (virus non enveloppés) particulièrement résistants.
Il est recommandé que les patients recevant régulièrement KASKADIL soient correctement vaccinés contre l'hépatite A et l'hépatite B.
KASKADIL contient 39 mg de sodium par flacon de 10 ml et 78 mg de sodium par flacon de 20 ml. En tenir compte chez les personnes suivant un régime pauvre en sel, strict
Interactions avec d'autres médicaments
Prise ou utilisation d'autres médicaments
Les interactions de KASKADIL avec d'autres médicaments ne sont pas décrites.
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou à votre pharmacien.
Interactions avec les aliments et les boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
L'innocuité de KASKADIL chez la femme enceinte n'a pas été établie lors d'études cliniques.
En l'absence d'études expérimentales de reproduction et de fertilité effectuées chez l'animal et compte tenu de l'augmentation du risque thrombo-embolique pendant la grossesse, KASKADIL ne doit être prescrit au cours de la grossesse et de l'allaitement qu'en cas de nécessité absolue.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Conduite de véhicules et utilisation de machines
Les effets sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés.
Liste des excipients à effet notoire
Liste des excipients à effet notoire:sodium (sous forme de chlorure, de citrate et d'héparine).
3. COMMENT UTILISER KASKADIL, poudre et solvant pour solution injectable ?
Instructions pour un bon usage
Sans objet.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
Posologie
La posologie et la durée du traitement substitutif dépendent de la sévérité du déficit, de la localisation du saignement, du type de traitement à mettre en œuvre (préventif ou curatif), ainsi que de l'état clinique et biologique du patient.
Déficit en facteurs vitamine K dépendants induit par les antivitamines K:
Une seule administration sera en général suffisante, en attendant les 4 à 6 heures de délai d'action de la vitamine K, prescrite simultanément, sur les facteurs vitamine K dépendants.
Déficit constitutionnel en facteur II ou en facteur X:
·Le taux de récupération du facteur II est de 2 %, c'est à dire que l'injection d'1 UI/kg de facteur II augmente le taux circulant d'environ 2 %.
Le nombre total d'UI de F II à administrer est calculé selon la formule suivante:
nombre total d'UI de F II à administrer = augmentation souhaitée (%) du F II x poids (kg) x 0,5
·Le taux de récupération du facteur X est de 1,7 % c'est à dire que l'injection d'1 UI/kg de facteur X augmente le taux circulant d'environ 1,7 %.
Le nombre total d'UI de F X à administrer est calculé selon la formule suivante:
nombre total d'UI de F X à administrer = augmentation souhaitée (%) du F X x poids (kg) x 0,6
A titre indicatif, la posologie habituelle est de 20 à 40 UI/kg/24h pour chacun des facteurs FII et(ou) FX selon l'importance du déficit.
La fréquence des injections dépend du problème hémorragique à traiter ou à prévenir. Dans la majorité des cas une injection quotidienne sera nécessaire et une surveillance biologique régulière sera faite par les dosages plasmatiques des quatre facteurs de la coagulation dont la demi-vie est inégale, une heure après la fin de la perfusion.
Mode d'administration
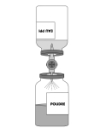
Reconstitution:
Respecter les règles d'asepsie habituelles.
|
|
|
 |
|
|
|
 |
|
|
|
 |
|
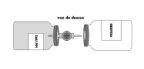
·Maintenir les deux flacons dans une position horizontale (évent vers le haut) et enfoncer rapidement l'extrémité libre du biseau au centre du bouchon du flacon de poudre. |
|
 |
|
|
|
 |
|
|
La solution est incolore ou bleutée et légèrement opalescente. Ne pas injecter de solution trouble ou contenant un dépôt.
Administration:
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Symptômes et instructions en cas de surdosage
Sans objet.
Instructions en cas d'omission d'une ou de plusieurs doses
Sans objet.
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, KASKADIL, poudre et solvant pour solution injectable est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet.
En cas d'injection d'une dose contenant une quantité de facteur IX supérieure à 40 UI/kg ou en cas d'administrations répétées, le risque potentiel de développer une coagulopathie de consommation ou une maladie thrombo-embolique (formation de caillots obstruant un vaisseau sanguin localement ou à distance) doit être pris en compte.
Si des réactions allergiques ou une allergie généralisée surviennent, l'administration doit être arrêtée immédiatement. En cas de choc, le traitement symptomatique de l'état de choc devra être instauré.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
5. COMMENT CONSERVER KASKADIL, poudre et solvant pour solution injectable ?
Tenir hors de la portée et de la vue des enfants
Ne pas utiliser KASKADIL, poudre et solvant pour solution injectable après la date de péremption mentionnée sur le flacon.
Après ouverture: le produit doit être utilisé immédiatement.
A conserver à une température ne dépassant pas 25 ºC. Ne pas congeler.
Conserver le conditionnement primaire dans l'emballage extérieur, à l'abri de la lumière.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
N'utilisez pas KASKADIL si vous constatez une solution trouble ou contenant un dépôt.
Les médicaments ne doivent pas être jetés au tout à l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient KASKADIL, poudre et solvant pour solution injectable ?
Les substances activesque Kaskadil contient sont les facteurs de coagulation humains suivants exprimés en UI:
|
Par 1 ml après reconstitution (U.I.) |
Pour un flacon de 10 ml de solution reconstituée (U.I.)1 |
Pour un flacon de 20 ml de solution reconstituée (U.I.)1 |
|
|
Facteur II de coagulation humain (Prothrombine) |
37 |
370 |
740 |
|
Facteur VII de coagulation humain (Proconvertine) |
10 |
1002 |
2002 |
|
Facteur IX de coagulation humain (Facteur antihémophilique B) |
25 |
250 |
500 |
|
Facteur X de coagulation humain (Facteur Stuart) |
40 |
400 |
800 |
La quantité totale de protéines est de 25 à 40 mg/ml de solution reconstituée.
L'activité spécifique en facteur IX est d'au moins 0,6 UI/mg de protéines.
1- Les activités de chaque facteur de la coagulation sont déterminées par la méthode de dosage décrite à la Pharmacopée Européenne par rapport à chaque étalon international de l'Organisation Mondiale de la Santé (OMS).
2- Le dosage du FVII s'effectue par une méthode amidolytique (FVII:am) qui mesure son activité biologique, c'est-à-dire la capacité du complexe facteur VIIa / facteur tissulaire à activer le facteur X en présence d'ions calcium et de phospholipides.Le taux de 10 UI/ml mesuré par cette méthode amidolytique (VII:am) correspond à un taux de 25 UI/ml dosé par la méthode coagulante (FVII:C) chronométrique.
Les autres composants sont:
Pour la poudre: le chlorure de sodium, le citrate de sodium et l'héparine sodique.
Pour le solvant: l'eau pour préparations injectables.
Forme pharmaceutique et contenu
Qu'est-ce que KASKADIL, poudre et solvant pour solution injectable et contenu de l'emballage extérieur ?
Ce médicament se présente sous forme de poudre et solvant pour solution injectable. Flacon de 10 ou 20 ml.
LFB-BIOMEDICAMENTS
3, avenue des Tropiques
ZA de Courtaboeuf
91940 Les Ulis
LFB-BIOMEDICAMENTS
3, Avenue des Tropiques
BP 305 LES ULIS
91958 COURTABOEUF CEDEX
FRANCE
LFB-BIOMEDICAMENTS
3, Avenue des Tropiques
BP 305 LES ULIS
91958 COURTABOEUF CEDEX
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Afssaps (France).
Informations réservées aux professionnels de santé
Sans objet.
Sans objet.