ANSM - Mis à jour le : 10/08/2004
INNOBRANDUO, poudre et solvant pour solution injectable
facteur Willebrand humain
facteur VIII de coagulation humain
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
Dans cette notice :
1. QU'EST-CE QUE INNOBRANDUO, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER INNOBRANDUO, poudre et solvant pour solution injectable ?
3. COMMENT UTILISER INNOBRANDUO, poudre et solvant pour solution injectable ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER INNOBRANDUO, poudre et solvant pour solution injectable ?
6. INFORMATIONS SUPPLEMENTAIRES
Sans objet.
Ce médicament contient du facteur Willebrand et du facteur VIII en association et est spécifiquement destiné au traitement de la maladie de Willebrand liée à un déficit quantitatif et(ou) parfois qualitatif en facteur Willebrand quand le traitement par la desmopressine (dDAVP) est inopérant ou contre-indiqué.
L'indication majeure est le traitement préventif et curatif des hémorragies graves dans des formes sévères de maladie de Willebrand avec un taux de facteur VIII < 20 %.
INNOBRANDUO ne doit pas être utilisé dans le traitement de l'hémophilie A.
Liste des informations nécessaires avant la prise du médicament
Sans objet.
N'utilisez jamais INNOBRANDUO, poudre et solvant pour solution injectable si vous êtes allergique à l'un des composants de la préparation.
Précautions d'emploi ; mises en garde spéciales
Faites attention avec INNOBRANDUO, poudre et solvant pour solution injectable :
Utiliser ce médicament AVEC PRECAUTION en cas desuspicion de réaction allergique à l'un des composants de la préparation.
Ce médicament n'est pas indiqué dans l'hémophilie A.
En cas d'allergie ou d'allergie généralisée, l'administration devra être interrompue immédiatement. En cas de choc, le traitement symptomatique de l'état de choc devra être instauré.
Le traitement substitutif de la maladie de Willebrand sans et, a fortiori, avec inhibiteur du facteur Willebrand doit être pris en charge ou surveillé par un spécialiste de l'hémostase.
En absence de réponse clinique après plusieurs injections d'une dose considérée comme correcte d'INNOBRANDUO, ou si le taux de facteur Willebrand n'atteint pas le niveau prévu, il est indispensable de rechercher la présence d'un inhibiteur du facteur Willebrand. Il faut alors en démontrer la présence dans le plasma et le titrer, à l'aide de tests biologiques appropriés.
Le risque de maladie infectieuse dû à la transmission d'agents infectieux ne peut pas être totalement exclu, lorsque sont administrés des médicaments préparés à partir de sang ou de plasma humain. Ceci s'applique également à des agents pathogènes de nature jusqu'ici inconnue.
Ce risque est cependant réduit par:
L'efficacité de l'élimination et(ou) de l'inactivation virale reste cependant limitée vis-à-vis de certains virus (virus non enveloppés), tels que le Parvovirus B19 et VHA.
Il est recommandé que les patients recevant régulièrement INNOBRANDUO soient correctement vaccinés contre l'hépatite A et l'hépatite B.
Interactions avec d'autres médicaments
Prise ou utilisation d'autres médicaments
Aucune interaction médicamenteuse avec INNOBRANDUO n'est connue à ce jour. Néanmoins le mélange préalable avec d'autres produits ou médicaments est formellement déconseillé.
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou à votre pharmacien.
Interactions avec les aliments et les boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
L'innocuité d'INNOBRANDUO au cours de la grossesse et de l'allaitement n'a pas été évaluée par des essais cliniques contrôlés. L'expérimentation animale est insuffisante pour établir la sécurité vis-à-vis de la reproduction, du déroulement de la grossesse, du développement de l'embryon ou du fœtus et du développement péri- et postnatal.
Par conséquent, INNOBRANDUO ne sera prescrit qu'en cas de nécessité absolue au cours de la grossesse ou de l'allaitement.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Conduite de véhicules et utilisation de machines
Rien ne suggère que l'utilisation d'INNOBRANDUO diminue l'aptitude à conduire un véhicule ou à utiliser une machine.
Liste des excipients à effet notoire
Informations importantes concernant certains composants d'INNOBRANDUO:
INNOBRANDUO contient des sels de sodium (chlorure, citrate).
3. COMMENT UTILISER INNOBRANDUO, poudre et solvant pour solution injectable ?
Instructions pour un bon usage
Sans objet.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
Posologie
Les doses à injecter sont en général de 50 UI/kg de facteur Willebrand et 25 UI/kg de facteur VIII.
Dans les cas graves, les doses peuvent aller jusqu'à 80 UI/kg de facteur Willebrand.
Le traitement est à renouveler toutes les 12 heures pendant 1 à plusieurs jours, puis toutes les 24 heures ultérieurement pendant une durée variable en fonction de l'état clinique et du suivi biologique strict du patient, qui devra être fait par un laboratoire d'hémostase spécialisé.
Après 24 à 48 h de ce traitement, une préparation de facteur Willebrand peut remplacer INNOBRANDUO avec la même efficacité sur l'hémostase primaire, ce qui évite l'apparition de taux trop élevés de facteur VIII.
En général, 1 UI/kg de WFR:Co augmente le taux circulant de 2 %.
Mode et voie d'administration
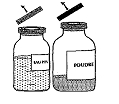
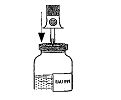
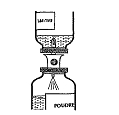
Reconstitution des solutions:
Respecter les règles d'asepsie habituelles.
Composant 1 contenant le facteur Willebrand:
|
|
|
 |
|
|
|
 |
|
|
|
 |
|
|
|
 |
|
|
|
 |
|
|
La solution obtenue est incolore ou légèrement opalescente. Ne pas utiliser de solution trouble ou contenant un dépôt.
Composant 2 contenant le facteur VIII:
Procéder de la même façon que pour le composant 1.
Administration:
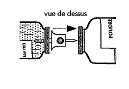
L'administration des solutions reconstituées peut se faire de façon séquentielle (administration de la solution n°1 contenant le facteur Willebrand puis de la solution n°2 contenant le facteur VIII) ou simultanée (mélange des deux solutions dans la même seringue).
Pour chaque étui, procéder de la façon suivante:
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Durée du traitement
Le traitement est à renouveler toutes les 12 heures pendant 1 à plusieurs jours, puis toutes les 24 heures ultérieurement pendant une durée variable en fonction de l'état clinique et du suivi biologique strict du patient, qui devra être fait par un laboratoire d'hémostase spécialisé.
Si vous avez l'impression que l'effet d'INNOBRANDUO est trop fort ou trop faible, consultez votre médecin ou votre pharmacien.
Symptômes et instructions en cas de surdosage
Si vous avez utilisé plus d'INNOBRANDUO que vous n'auriez dû:
Un risque de thrombose (formation de caillot obstruant un vaisseau sanguin) ne pouvant être exclu en cas de surdosage, une surveillance biologique devra être instaurée à la recherche des marqueurs précoces d'activation de la coagulation et la prévention des complications thrombo-emboliques (formation de caillot obstruant un vaisseau sanguin localement ou à distance) selon les recommandations en usage devra être mise en œuvre.
Instructions en cas d'omission d'une ou de plusieurs doses
Si vous oubliez d'utiliser INNOBRANDUO:
Ne prenez pas de dose double pour compenser la dose simple que vous avez oublié de prendre.
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, INNOBRANDUO, poudre et solvant pour solution injectable est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
5. COMMENT CONSERVER INNOBRANDUO, poudre et solvant pour solution injectable ?
Tenir hors de la portée et de la vue des enfants.
Ne pas utiliser INNOBRANDUO, poudre et solvant pour solution injectable après la date de péremption mentionnée sur le conditionnement extérieur.
A conserver entre + 2°C et + 8°C (au réfrigérateur) et à l'abri de la lumière.
Pendant la durée de conservation, ce médicament peut être conservé à une température ne dépassant pas + 25°C pendant 6 mois maximum sans être à nouveau réfrigéré pendant cette période et doit être jeté s'il n'est pas utilisé au bout de ces 6 mois. Ne pas congeler.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Ne pas administrer de solution trouble ou contenant un dépôt.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient INNOBRANDUO, poudre et solvant pour solution injectable ?
Les substances actives sont:
Les autres composants sont:
Forme pharmaceutique et contenu
Qu'est-ce que INNOBRANDUO, poudre et solvant pour solution injectable et contenu de l'emballage extérieur ?
INNOBRANDUO se présente sous la forme de poudres et de solvants pour solution injectable (flacon de 20 ml pour le solvant 1 et flacon de 5 ml pour le solvant 2) avec deux systèmes de transfert munis d'un évent à filtre stérilisant et deux aiguilles-filtre, boîte de 1.
LFB-BIOMEDICAMENTS
3, avenue des Tropiques
ZA de Courtaboeuf
91940 Les Ulis
LABORATOIRE FRANÇAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES
3, Avenue des Tropiques
BP 305
LES ULIS
91958 COURTABŒUF CEDEX
LABORATOIRE FRANÇAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES
3, Avenue des Tropiques
BP 305
LES ULIS
91958 COURTABŒUF CEDEX
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Afssaps (France).
Informations réservées aux professionnels de santé
Sans objet.
Sans objet.
