ANSM - Mis à jour le : 08/02/2022
FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplieFulvestrant Veuillez lire attentivement cette notice avant d'utiliser ce médicament car elle contient des informations importantes pour vous.· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d'autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d'autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplie ?
3. Comment utiliser FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplie ?
6. Contenu de l'emballage et autres informations.
Les estrogènes, un type d'hormones sexuelles féminines, peuvent dans certains cas être impliqués dans la croissance du cancer du sein.
FULVESTRANT SANDOZ est utilisé soit :
Lorsque FULVESTRANT SANDOZ est administré en association avec le palbociclib, il est important que vous lisiez aussi la notice du palbociclib. Si vous avez des questions concernant le palbociclib, demandez à votre médecin.
N'utilisez jamais FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplie :·si vous êtes allergique au fulvestrant ou à l'un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6),
·si vous êtes enceinte ou si vous allaitez,
·si vous avez des problèmes hépatiques sévères.
Avertissements et précautionsAdressez-vous à votre médecin, pharmacien ou infirmier/ère avant d'utiliser FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplie si vous êtes concernée par l'une des situations ci-dessous :
·alcoolisme.
Enfants et adolescentsFULVESTRANT SANDOZ n'est pas indiqué chez les enfants et les adolescents en-dessous de 18 ans.
Autres médicaments et FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplieInformez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
En particulier, vous devez informer votre médecin si vous prenez des anticoagulants (médicaments destinés à empêcher la formation de caillots sanguins).
Grossesse et allaitementSi vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Vous ne devez pas utiliser FULVESTRANT SANDOZ en cas de grossesse. Si vous êtes en âge de procréer, vous devez utiliser une contraception efficace pendant le traitement par FULVESTRANT SANDOZ et pendant 2 ans après avoir reçu votre dernière dose.
Vous ne devez pas allaiter pendant le traitement par FULVESTRANT SANDOZ.
Conduite de véhicules et utilisation de machinesOn ne s'attend pas à ce que FULVESTRANT SANDOZ puisse influencer l'aptitude à conduire une voiture ou à utiliser des machines. Cependant si vous ressentez de la fatigue après administration du traitement, ne conduisez pas ou n'utilisez pas de machines.
FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplie contient de l'éthanol, de l'alcool benzylique et du benzoate de benzyleCe médicament contient 1000 mg d'alcool (éthanol 96 %) par dose, équivalant à 100 mg/mL (10 % p/v). La quantité par dose de ce médicament équivaut à moins de 24 mL de bière ou 10 mL de vin.
La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
Ce médicament contient 1000 mg d'alcool benzylique par dose, équivalant à 100 mg/mL.
L'alcool benzylique peut provoquer des réactions allergiques.
L'alcool benzylique a été associé à des risques d'effets secondaires graves, y compris des problèmes respiratoires (appelés « syndrome haletant ») chez les jeunes enfants.
Ne le donnez pas à votre nouveau-né (jusqu'à 4 semaines), sauf sur recommandation de votre médecin.
Ne pas utiliser pendant plus d'une semaine chez les jeunes enfants (âgés de moins de 3 ans), sauf avis contraire de votre médecin ou pharmacien.
Demandez conseil à votre médecin ou votre pharmacien si vous avez une maladie du foie ou des reins. De grandes quantités d'alcool benzylique peuvent s'accumuler dans votre corps et peuvent provoquer des effets secondaires (appelés « acidose métabolique »).
Ce médicament contient 1500 mg de benzoate de benzyle par dose, équivalant à 150 mg/mL.
Le benzoate de benzyle peut augmenter le risque de jaunisse (coloration jaune de la peau et des yeux) chez les nouveau-nés (jusqu'à 4 semaines après la naissance).
3. COMMENT UTILISER FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplie ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
La dose recommandée est de 500 mg de fulvestrant (deux injections de 250 mg) une fois par mois, avec une dose supplémentaire de 500 mg 2 semaines après la dose initiale.
Votre médecin ou votre infirmier/ère vous administrera FULVESTRANT SANDOZ en injection intra-musculaire lente, une dans chaque fesse.
Si vous avez d'autres questions concernant l'utilisation de ce médicament, demandez à votre médecin, votre pharmacien ou votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Vous pourriez avoir besoin d'un traitement médical en urgence si vous présentez l'un des effets indésirables suivants :· douleurs articulaires et musculo-squelettiques,
·bouffées de chaleur,
·éruptions cutanées,
·réactions allergiques (hypersensibilité) y compris gonflement du visage, des lèvres, de la langue et/ou de la gorge.
Autres effets indésirables :Effets indésirables fréquents (peuvent concerner jusqu'à 1 personne sur 10)·taux de plaquettes diminué (thrombocytopénie),
·faiblesse soudaine, engourdissements, picotements ou perte de mouvement dans votre jambe, en particulier sur un seul côté de votre corps, des problèmes soudains pour marcher ou d'équilibre (neuropathie périphérique).
Effets indésirables peu fréquents (peuvent concerner jusqu'à 1 personne sur 100)·réactions anaphylactiques.
* inclus des effets indésirables pour lesquels le rôle exact de FULVESTRANT SANDOZ ne peut pas être évalué en raison de la maladie sous-jacente.
Déclaration des effets secondairesSi vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d'informations sur la sécurité du médicament.
5. COMMENT CONSERVER FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N'utilisez pas ce médicament après la date de péremption indiquée sur l'emballage ou l'étiquette de la seringue après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Votre professionnel de santé sera responsable du bon stockage, de l'utilisation et de l'élimination du fulvestrant.
Ne pas utiliser ce médicament si vous remarquez que le dispositif ou le contenu est détérioré tel qu'une seringue endommagée, une solution trouble, des particules en suspension ou un changement de couleur de la solution.
Les médicaments ne doivent pas être jetés au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. CONTENU DE L'EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FULVESTRANT SANDOZ 250 mg, solution injectable en seringue pré-remplie
Chaque seringue pré-remplie contient 250 mg de fulvestrant dans 5 mL de solution (50 mg/mL).
FULVESTRANT SANDOZ est une solution limpide, incolore à jaune, visqueuse dans une seringue pré-remplie.
FULVESTRANT SANDOZ est fourni en une ou deux seringues pré-remplies à usage unique.
De plus une aiguille stérile est fournie.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l'autorisation de mise sur le marché
SANDOZ49, AVENUE GEORGES POMPIDOU
92300 LEVALLOIS-PERRET
Exploitant de l'autorisation de mise sur le marché
SANDOZ49, AVENUE GEORGES POMPIDOU
92300 LEVALLOIS-PERRET
LEK PHARMACEUTICALS D.D.VEROVSKOVA ULICA 57,
1526 LJUBLJANA
SLOVENIE
OU
EBEWE PHARMA GES.M.B.H NFG.KGMONDSEESTRASSE 11,
4866 UNTERACH AM ATTERSEE
AUTRICHE
OU
FAREVA UNTERACH GMBHMONDSEESTRASSE 11
4866 UNTERACH
AUTRICHE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l'ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :Fulvestrant 500 mg (2 x 250 mg/5 mL en solution injectable) doit être administré en utilisant deux seringues pré-remplies, voir rubrique 3.
Instructions pour l'administrationAvertissement - Ne jamais stériliser à l'autoclave l'aiguille protégée avant l'utilisation. Pendant toute la durée de l'utilisation et de la procédure d'élimination de l'aiguille, les mains doivent toujours rester derrière l'aiguille.
Les seringues sont fournies avec des aiguilles protégées BD SafetyGlide® ou Terumo SurGuard®.
Instructions pour les aiguilles protégées BD SafetyGlide®Pour chacune des deux seringues :
·retirez l'emballage extérieur de l'aiguille protégée (BD SafetyGlide®). Fixez l'aiguille protégée sur le connecteur Luer-Lock,
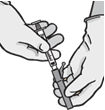


Pour chacune des deux seringues :


oavec le doigt,
oavec le pouce,
oavec une surface.

Les seringues pré-remplies sont exclusivement à usage unique.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
[1] A préciser pour les demandes de modification et indiquer le code la modification selon les lignes directrices https://ec.europa.eu/health//sites/health/files/files/eudralex/vol-2/c_2013_2008/c_2013_2008_pdf/c_2013_2804_fr.pdf