ANSM - Mis à jour le : 08/02/2023
FIBRYGA 1 gPoudre et solvant pour solution injectable/pour perfusionFibrinogène humain Veuillez lire attentivement cette notice avant d'utiliser ce médicament car elle contient des informations importantes pour vous.·Gardez cette notice. Vous pourriez avoir besoin de la relire.
·Si vous avez d'autres questions, interrogez votre médecin ou votre pharmacien.
·Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d'autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
·Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FIBRYGA, poudre et solvant pour solution injectable/pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FIBRYGA, poudre et solvant pour solution injectable/pour perfusion ?
3. Comment utiliser FIBRYGA, poudre et solvant pour solution injectable/pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FIBRYGA, poudre et solvant pour solution injectable/pour perfusion ?
6. Contenu de l'emballage et autres informations.
Classe pharmacothérapeutique : antihémorragiques, fibrinogène humain, code ATC : B02BB01Qu'est-ce que FIBRYGA, poudre et solvant pour solution injectable/pour perfusion ?FIBRYGA contient du fibrinogène humain, une protéine importante pour la coagulation du sang. Un manque en fibrinogène fait que le sang ne coagule pas aussi bien qu'il ne le devrait, ce qui augmente la tendance aux saignements. Le remplacement du fibrinogène humain par FIBRYGA corrigera le défaut de coagulation.
Dans quel cas FIBRYGA, poudre et solvant pour solution injectable/pour perfusion est-il utilisé ?FIBRYGA est utilisé pour :
·si vous êtes allergique au fibrinogène humain ou à l'un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
Adressez-vous à votre médecin ou pharmacien avant d'utiliser FIBRYGA.
Risque de caillots dans les vaisseaux sanguins
Votre médecin doit évaluer les avantages de ce médicament au regard du risque de caillot dans les vaisseaux sanguins, en particulier si :
·vous avez reçu une forte dose ou des doses répétées de ce médicament,
·vous avez eu une crise cardiaque (antécédents d'atteinte des artères coronaires ou d'infarctus du myocarde),
·vous avez une maladie du foie (hépatique),
·vous venez de subir une intervention chirurgicale (patients en période postopératoire),
·vous allez subir une intervention chirurgicale (patients en période préopératoire),
·chez les nouveau-nés,
·vous êtes susceptible de développer des caillots sanguins ou des problèmes de coagulation dans les vaisseaux sanguins (patients à risque d'événements thromboemboliques ou de coagulation intravasculaire disséminée).
Votre médecin peut vous demander de subir des tests supplémentaires de coagulation du sang afin de contrôler le risque.
Réactions allergiques ou de type anaphylactique
Tout médicament, tel que FIBRYGA, préparé à partir de sang humain (qui contient des protéines) et qui est injecté dans une veine (administré par voie intraveineuse) peut entraîner des réactions allergiques. Si vous avez présenté dans le passé des réactions allergiques à FIBRYGA, votre médecin vous indiquera si un médicament antiallergique est nécessaire.
Votre médecin vous expliquera quels sont les signes d'alerte d'une réaction allergique ou d'une réaction de type anaphylactique.
Veuillez être attentifs aux signes précoces de réactions allergiques (hypersensibilité), notamment :·ou anaphylaxie (quand n'importe lequel ou tous les symptômes précédents se développent rapidement et sont intenses).
·Si cela survient, l'injection/la perfusion de FIBRYGA doit être arrêtée immédiatement.
Sécurité vis-à-vis des virus
Lorsque des médicaments sont fabriqués à partir de sang ou de plasmas humains, certaines mesures sont prises pour éviter que des infections soient transmises aux patients. Elles incluent :
·une sélection soigneuse des donneurs de sang et de plasma pour assurer que les donneurs susceptibles d'être porteurs d'infections sont exclus,
Malgré ces mesures, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, la possibilité de transmettre une infection ne peut pas être totalement écartée. Cela concerne également des virus inconnus ou émergents ou d'autres types de pathogènes.
Les mesures prises sont jugées efficaces contre les virus enveloppés, tels que le virus de l'immunodéficience humaine (VIH), le virus de l'hépatite B et le virus de l'hépatite C, et contre les virus non enveloppés tels que le virus de l'hépatite A. Les mesures prises peuvent n'avoir qu'une efficacité limitée contre les virus non enveloppés, tels que le parvovirus B19.
L'infection par le parvovirus B19 peut être grave chez la femme enceinte (infection de l'enfant à naître) et chez les personnes ayant un système immunitaire déprimé ou présentant certaines formes d'anémie (par exemple, une drépanocytose ou destruction anormale des globules rouges).
Chaque fois que vous recevez une dose de FIBRYGA, il est fortement recommandé que le nom et le numéro de lot du produit soient notés afin de conserver une traçabilité des lots utilisés.
Votre médecin pourrait vous recommander d'envisager une vaccination contre l'hépatite A et l'hépatite B si vous recevez régulièrement/de façon répétée des produits à base de fibrinogène d'origine plasmatique.
Enfants et adolescentsIl n'y a aucun avertissement et aucune mise en garde spécifique ou supplémentaire pour les enfants et les adolescents.
Autres médicaments et FIBRYGA, poudre et solvant pour solution injectable/pour perfusionInformez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
FIBRYGA ne doit pas être mélangé avec d'autres médicaments hormis ceux cités dans la rubrique « Les informations suivantes sont destinées exclusivement aux professionnels de la santé / Reconstitution ».
Grossesse, allaitement et fertilitéSi vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament. Ce produit ne doit être pris pendant la grossesse ou l'allaitement qu'après avoir demandé l'avis de votre médecin ou pharmacien.
Conduite de véhicules et utilisation de machinesFIBRYGA n'a aucune influence sur l'aptitude à conduire des véhicules et à utiliser des machines.
FIBRYGA, poudre et solvant pour solution injectable/pour perfusion contient du sodium.Ce médicament contient jusqu'à 132 mg de sodium (composant principal du sel de cuisine/table) dans chaque flacon. Cela équivaut à 6,6 % de l'apport alimentaire quotidien maximal recommandé de sodium pour un adulte. Cela doit être pris en compte chez les patients suivant un régime contrôlé en sodium.
3. COMMENT utiliser FIBRYGA, poudre et solvant pour solution injectable/pour perfusion ?
FIBRYGA est administré par perfusion intraveineuse (perfusion dans une veine) par un professionnel de la santé.
La dose et la posologie dépendent de :
L'administration de FIBRYGA chez les enfants et adolescents (voie intraveineuse) n'est pas différente de celle des adultes.
Si vous avez utilisé plus de FIBRYGA, poudre et solvant pour solution injectable/pour perfusion que vous n'auriez dûPour éviter le risque de surdosage, votre médecin effectuera régulièrement des analyses de sang pour doser votre taux de fibrinogène.
En cas de surdosage, il peut y avoir une augmentation du risque de caillots anormaux dans vos vaisseaux sanguins.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'information à votre médecin ou à votre pharmacien.
Si vous avez utilisé ou trop pris de FIBRYGA, prenez immédiatement contact avec votre médecin ou votre pharmacien.
Mode d'administrationCe médicament doit être injecté ou perfusé dans les veines après reconstitution avec le solvant fourni. Si vous avez d'autres questions sur l'utilisation de ce produit, demandez plus d'information à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Veuillez communiquer immédiatement avec votre médecin :· si l'un des effets indésirables survient,
· si vous constatez un effet indésirable qui ne serait pas mentionné dans cette notice.
Les effets indésirables suivants ont été décrits pour FIBRYGA et d'autres produits à base de fibrinogène (la fréquence des effets indésirables cités n'est pas connue) :
·Réactions allergiques ou de type anaphylactique : réactions cutanées telles que rash ou rougeur cutanée (voir rubrique 2 « Avertissements et précautions »)
·Affections cardiovasculaires : inflammation des veines et formation de caillots sanguins (voir rubrique 2 « Avertissements et précautions »)
Si vous ressentez l'un des symptômes ci-dessus, contactez votre médecin le plus tôt possible.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d'informations sur la sécurité du médicament.
5. COMMENT CONSERVER FIBRYGA, poudre et solvant pour solution injectable/pour perfusion ?
Tenir hors de la vue et de la portée des enfants.
N'utilisez pas ce médicament après la date de péremption indiquée sur l'étiquette et l'emballage. La date de péremption fait référence au dernier jour de ce mois.
Conserver à une température ne dépassant pas 25 °C. Ne pas congeler. Conserver le flacon dans l'emballage d'origine à l'abri de la lumière.
La poudre doit être dissoute immédiatement avant l'injection/la perfusion. La stabilité de la solution reconstituée pendant 24 heures à température ambiante a été démontrée (maximum 25°C). Néanmoins, afin de prévenir toute contamination, la solution doit être utilisée immédiatement et en une seule fois. Le produit reconstitué ne doit pas être conservé au réfrigérateur ou au congélateur.
Ne jetez aucun médicament au tout-à-l'égout ni avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribuent à protéger l'environnement.
6. CONTENU DE L'EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FIBRYGA, poudre et solvant pour solution injectable/pour perfusion
FIBRYGA contient 1 g de fibrinogène humain par flacon ou 20 mg/ml de fibrinogène humain après reconstitution avec le solvant fourni (50 ml d'eau pour préparations injectables).
FIBRYGA est présenté sous la forme d'une poudre et d'un solvant pour solution injectable/pour perfusion et est disponible en flacons en verre.
La poudre hygroscopique, ayant également l'aspect d'un solide friable, est de couleur blanche ou jaune pâle.
Le solvant est un liquide transparent et incolore.
La solution reconstituée est presque incolore et légèrement opalescente.
FIBRYGA est vendu dans une boîte contenant :
Titulaire de l'autorisation de mise sur le marché
OCTAPHARMA FRANCE62 BIS AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
Exploitant de l'autorisation de mise sur le marché
OCTAPHARMA FRANCE62 BIS AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
OCTAPHARMA PHARMAZEUTIKA PRODUKTIONSGES.M.B.H.OBERLAAER STRASSE 235
1100 VIENNE
AUTRICHE
ou
OCTAPHARMA ABLARS FORSSELLS GATA 23
112 75 STOCKHOLM
SUÈDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Les informations suivantes sont destinées exclusivement aux professionnels de santé : PosologieLa dose et la durée du traitement substitutif dépendent de la sévérité des troubles, de la localisation, de l'étendue du saignement, et de l'état clinique du patient. La concentration (fonctionnelle) en fibrinogène doit être déterminée afin de calculer la posologie individuelle. Le nombre et la fréquence des injections doivent être adaptés à chaque patient en fonction du dosage régulier de la concentration plasmatique en fibrinogène et du suivi continu de l'état clinique du patient, et des autres traitements de substitution utilisés. En cas d'intervention chirurgicale majeure, une surveillance étroite du traitement de substitution par des tests de coagulation est essentielle.
1. Prophylaxie chez des patients présentant une hypo- ou afibrinogènémie congénitale avec une tendance connue aux saignements.
Pour prévenir un saignement excessif au cours de procédures chirurgicales, un traitement prophylactique est recommandé pour augmenter la concentration en fibrinogène jusqu'à 1 g/l puis de la maintenir à ce niveau jusqu'à l'obtention de l'hémostase, et au-dessus de 0,5 g/l jusqu'à guérison complète des plaies.
En cas de procédure chirurgicale ou de traitement d'un épisode de saignement, la dose doit être calculée comme suit :
Dose (mg/kg de poids corporel) = [Concentration cible (g/L) - concentration mesurée (g/L)]
0,018 (g/L par mg/kg de poids corporel)
La posologie suivante (dose et fréquence des injections) doit être adaptée en fonction de l'état clinique du patient et des résultats des tests de laboratoire.
La demi-vie biologique du fibrinogène est de 3 à 4 jours. Ainsi, en l'absence de dégradation, un traitement répété avec le fibrinogène humain n'est habituellement pas nécessaire. Compte tenu de l'accumulation survenant en cas d'administration répétée dans un but prophylactique, la dose et la fréquence doivent être déterminées en fonction des objectifs thérapeutiques du médecin pour chaque patient.
Population pédiatrique
En cas de procédure chirurgicale ou de traitement d'un épisode de saignement, la dose pour les adolescents doit être calculée selon la formule indiquée ci‑dessus pour les adultes, tandis que la dose pour les enfants âgés de moins de 12 ans doit être calculée comme suit :
Dose (mg/kg de poids corporel) = [Concentration cible (g/L) - concentration mesurée (g/L)]
0,014 (g/L par mg/kg de poids corporel)
La posologie doit être adaptée en fonction de l'état clinique du patient et des résultats des tests de laboratoire.
Patients âgés
Les études cliniques menées avec FIBRYGA n'ont pas inclus de patients âgés de 65 ans et plus pour fournir des données probantes et concluantes permettant de savoir si ces patients répondent différemment au traitement par rapport à des patients plus jeunes.
2. Traitement des saignements
Saignements chez des patients présentant une hypo- ou afibrinogènémie congénitale
Les épisodes de saignement doivent être traités en utilisant les formules ci-dessus adaptées aux adultes/adolescents ou aux enfants, respectivement, de manière à atteindre la concentration plasmatique cible de 1 g/l recommandée en fibrinogène. Ce taux doit être maintenu jusqu'à ce qu'une hémostase durable soit obtenue.
Saignements chez des patients présentant un déficit acquis en fibrinogène
Adultes
Une dose de 1-2 g est généralement administrée initialement, suivie de perfusions autant que nécessaire. En cas d'hémorragie sévère, par exemple au cours d'une intervention chirurgicale majeure, de grandes quantités (4-8 g) de fibrinogène peuvent être nécessaires.
Population pédiatrique
La posologie doit être déterminée en fonction du poids corporel et des besoins cliniques mais se situe généralement entre 20 et 30 mg/kg.
Instructions pour la préparation et l'administrationInstructions généralesLa solution reconstituée doit être presque incolore et légèrement opalescente. Ne pas utiliser les solutions troubles ou présentant des dépôts.
Reconstitution| 1. Réchauffer, si nécessaire, à température ambiante, la poudre et le solvant (eau pour préparations injectables) dans des contenants non ouverts. Cette température doit être maintenue pendant la reconstitution. Si un bain-marie est utilisé pour le réchauffement, il faut veiller à éviter que l'eau n'entre en contact avec les bouchons ou capuchons en caoutchouc des contenants. La température du bain-marie ne doit pas dépasser 37 °C. | |||||||||||||||||||||||||||||||||||||
| 2. Retirer l'opercule du flacon de poudre (FIBRYGA) et du solvant afin d'exposer la partie centrale du bouchon pour la perfusion. Nettoyer les bouchons en caoutchouc avec un tampon alcoolisé et laisser sécher les bouchons. | |||||||||||||||||||||||||||||||||||||
| 3. Enlever la pellicule du couvercle de l'emballage extérieur du dispositif de transfert Octajet. Laisser le dispositif Octajet dans l'emballage extérieur transparent afin de maintenir sa stérilité. | |||||||||||||||||||||||||||||||||||||
| 4. Saisir l'Octajet dans son emballage extérieur et le renverser au-dessus du flacon de poudre (FIBRYGA). Placer le dispositif toujours maintenu dans son emballage extérieur sur le centre du flacon de poudre jusqu'au verrouillage des clips de la pointe du produit (incolore). Tout en tenant le flacon de poudre, retirer délicatement l'emballage extérieur de l'Octajet en faisant attention à ne pas toucher la pointe (bleue) pour l'eau et laisser l'Octajet solidement fixé sur le flacon de poudre. (Fig. 1) |
 |
||||||||||||||||||||||||||||||||||||
| 5. Le flacon de poudre (FIBRYGA) étant tenu fermement sur une surface horizontale, renverser le flacon de solvant et le placer au centre de la pointe pour l'eau. Pousser fermement sur la pointe de l'Octajet pour l'enfoncer au travers du bouchon en caoutchouc du flacon de solvant. (Fig. 2) |
 |
||||||||||||||||||||||||||||||||||||
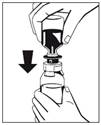
6. Retirer l'anneau séparateur (Fig. 3) et enfoncer complètement le flacon de solvant (Fig. 4). Le solvant s'écoulera dans le flacon de poudre (FIBRYGA).
  |
|||||||||||||||||||||||||||||||||||||
| 7. Lorsque le transfert du solvant est terminé, faire tournoyer doucement le flacon de produit jusqu'à dissolution complète de la poudre. Ne pas secouer le flacon pour éviter la formation de mousse. La poudre doit être dissoute complètement en environ 5 minutes. La dissolution de la poudre ne doit pas prendre plus de 20 minutes. Si la poudre n'est pas dissoute dans les 20 minutes, le produit doit être éliminé.Dans de rares cas, un amas flottant de produit non reconstitué peut être observé dans le flacon de poudre pendant le transfert de l'eau pour préparations injectables, ou la durée de reconstitution peut être plus longue que prévu. Dans ce cas, ne pas secouer le flacon verticalement afin d'éviter toute fuite de liquide au niveau du connecteur du flacon. Une fois la masse complètement désintégrée, la reconstitution s'observe dans le délai prévu. | |||||||||||||||||||||||||||||||||||||
| 8. Tourner le connecteur bleu du flacon de solvant (deux sens possibles) pour amener les marqueurs à la même position et retirer le flacon de solvant en même temps que la pointe pour l'eau. (Fig. 5) |
 |
||||||||||||||||||||||||||||||||||||
|
9.Fixer une seringue au filtre fourni (Fig. 6) et raccorder le filtre au raccord Luer Lock de l'Octajet sur le flacon de poudre (Fig. 7). Aspirer la solution dans la seringue au travers du filtre. (Fig. 8)
|
|||||||||||||||||||||||||||||||||||||
10. Détacher la seringue remplie du filtre et éliminer le flacon vide. |
|||||||||||||||||||||||||||||||||||||
Un ensemble standard pour perfusion est recommandé pour l'administration intraveineuse de la solution reconstituée à température ambiante.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation locale en vigueur.
Mode d'administrationPerfusion ou injection intraveineuse.
FIBRYGA doit être administré lentement par voie intraveineuse à la vitesse maximale recommandée de 5 ml/min chez les patients présentant une hypo- ou afibrinogènémie congénitale. La vitesse maximale recommandée est de 10 ml/min chez les patients présentant un déficit acquis en fibrinogène.
IncompatibilitésCe médicament ne doit pas être mélangé avec d'autres médicaments.