ANSM - Mis à jour le : 07/09/2010
EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion
Epoprosténol
Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
Dans cette notice :
1. QU'EST-CE QUE EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion ?
3. COMMENT UTILISER EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion ?
6. INFORMATIONS SUPPLEMENTAIRES
Sans objet.
L'époprosténol est utilisé pour réduire la pression artérielle élevée dans les poumons (hypertension artérielle pulmonaire). Dans ce cas, il dilate les vaisseaux sanguins dans les poumons, ce qui fait baisser la pression artérielle dans les vaisseaux. Cet effet correspond à une vasodilatation.
Liste des informations nécessaires avant la prise du médicament
Sans objet.
N'utilisez jamais EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion:
·Si vous êtes allergique (hypersensible) à l'époprosténol ou à un autre composant de ce médicament (voir la rubrique 6 « Informations supplémentaires » à la fin de cette notice).
Précautions d'emploi ; mises en garde spéciales
Faites attention avec EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion:
Interactions avec d'autres médicaments
Utilisation d'autres médicaments
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin.
En particulier, indiquez à votre médecin si vous prenez l'un des médicaments suivants:
Dans ce cas, avertissez votre médecin car des précautions peuvent être nécessaires.
Interactions avec les aliments et les boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse
L'utilisation de l'époprosténol chez la femme enceinte n'a pas été étudiée. Bien que les études chez l'animal n'ont pas mis en évidence d'anomalies sur le développement embryonnaire ou à la naissance, son utilisation n'est pas recommandée chez la femme enceinte sauf en cas d'absolue nécessité. Prévenez votre médecin si vous êtes enceinte ou susceptible de le devenir.
Allaitement
Le passage de ce médicament dans le lait maternel n'est pas connu. Les mères qui prennent ce médicament et souhaitent allaiter doivent en discuter avec leur médecin.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Conduite de véhicules et utilisation de machines
L'effet du traitement par EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion sur la capacité à conduire des véhicules ou à utiliser des machines n'a pas été étudié.
L'hypertension artérielle pulmonaire peut, par elle-même, induire une altération de votre capacité à conduire des véhicules ou à utiliser des machines. Si vous ressentez des vertiges ou une somnolence, votre capacité à conduire des véhicules ou à utiliser des machines peut être affectée et vous devez éviter de conduire des véhicules ou d'utiliser des machines.
Liste des excipients à effet notoire
Informations importantes concernant certains composants de EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion:
Ce médicament contient 2,4 mmol (ou 56 mg) de sodium par dose. A prendre en compte chez les patients suivant un régime hyposodé strict.
3. COMMENT UTILISER EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion ?
Instructions pour un bon usage
Sans objet.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
Dans le traitement de l'hypertension artérielle pulmonaire (pression artérielle sanguine élevée dans le poumon) l'époprosténol est administré uniquement en perfusion intraveineuse. L'époprostenol sera administré par l'intermédiaire d'une aiguille intraveineuse (cathéter) fixe (maintenu en permanence). Dans un premier temps, l'administration peut être faite par l'intermédiaire d'un cathéter provisoire.
Votre traitement par l'époprosténol sera initié à l'hôpital. Votre médecin débutera le traitement avec un faible débit de perfusion. Ce débit sera augmenté petit à petit jusqu'à trouver la dose qui est la plus efficace pour vous. Pendant cette phase du traitement, votre médecin surveillera la manière dont votre organisme réagit à l'époprosténol. Si des difficultés respiratoires apparaissent, dues à la survenue d'un œdème aigu du poumon (œdème aigu pulmonaire), votre médecin pourra choisir de mettre fin à votre traitement par l'époprosténol.
Normalement, votre médecin augmentera ou diminuera votre débit de perfusion en fonction de votre réponse au traitement. Tous les changements doivent être réalisés graduellement et sous la supervision du médecin. Votre perfusion d'époprosténol sera administrée au moyen d'une pompe à perfusion. Votre médecin veillera à ce que vous utilisiez le type de pompe approprié. En cas de doute, demandez conseil à votre médecin.
Afin d'éviter d'éventuelles interruptions dans l'administration du médicament en cas de dysfonctionnement accidentel du système, assurer vous toujours d'avoir un accès immédiat en cas de besoin à une pompe et du matériel pour perfusion de rechange.
EPOPROSTENOL SANDOZ, poudre et solvant pour solution pour perfusion, ne doit pas être administré en bolus (en injection intraveineuse directe).
Enfants et sujets âgés
En raison du manque d'informations, l'utilisation de l'époprosténol n'est pas recommandée chez l'enfant ou le sujet âgé de plus de 65 ans.
Symptômes et instructions en cas de surdosage
Si vous avez utilisé plus de EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion, que vous n'auriez dû:
Le traitement par l'époprosténol est normalement mis en œuvre dans un hôpital ou une clinique. Votre médecin en surveillera attentivement les effets. Dans le cas peu probable où vous receviez une dose excessive, votre médecin pourra prendre rapidement les mesures qui s'imposent, comme une réduction de la dose administrée. L'administration d'une dose trop importante d'époprosténol peut provoquer une forte baisse de la tension artérielle, qui peut éventuellement causer un évanouissement.
Instructions en cas d'omission d'une ou de plusieurs doses
Si vous oubliez d'utiliser EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion:
Une interruption, même brève, de l'administration de l'époprosténol peut rendre le traitement inefficace. Si votre traitement s'interrompt pour quelque raison que ce soit, prévenez votre médecin immédiatement.
Si vous arrêtez d'utiliser EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion:
L'interruption brutale du traitement par l'époprosténol peut provoquer un essoufflement, des vertiges, un malaise qui peut aller jusqu'au décès.
Vous devez toujours consulter votre médecin avant tout ajustement de dose. Vous ne devez jamais arrêter votre traitement de vous-même.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, l'époprosténol est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet.
L'évaluation du risque de survenue d'effets indésirables s'appuie sur les fréquences suivantes:
Très fréquent: survient chez plus d'un patient sur 10
Fréquent: survient chez 1 à 10 patients sur 100
Peu fréquent: survient chez 1 à 10 patients sur 1 000
Rare: survient chez 1 à 10 patients sur 10 000
Très rare: survient chez moins de 1 patient sur 10 000
Fréquence indéterminée: la fréquence de survenue ne peut être estimée sur la base des données disponibles
Les effets indésirables suivants ont été observés:
Très fréquent:
Maux de tête.
Bouffées de chaleur ou rougeur au visage.
Nausées et vomissements.
Diarrhées.
Douleurs dans la mâchoire.
Fatigue et faiblesse générale.
Fréquent:
Symptômes d'infections (sepsis, septicémie) telles que frissons, fièvre, tremblements, confusion et respiration rapide.
Diminution du nombre de plaquettes sanguines (cellules présentes dans le sang).
Saignements au niveau de divers organes (poumons, estomac ou intestins, nez, cerveau ou abdomen).
Anxiété, nervosité.
Accélération (tachycardie) ou ralentissement (bradycardie) du rythme cardiaque.
Gêne/douleur abdominale.
Eruption cutanée.
Douleurs articulaires.
Douleur au niveau de la perfusion.
Douleur dans le thorax.
Diminution de pression artérielle (hypotension).
Peu fréquent:
Sécheresse de la bouche.
Rare:
Infection locale.
Très rare:
Excitation (agitation).
Pâleur de la peau.
Rougeur au point de perfusion.
Fatigue.
Oppression thoracique (douleur dans la poitrine).
Transpiration.
Fréquence indéterminée:
Essoufflement.
Augmentation du taux de sucre dans le sang (hyperglycémie).
Réactions cutanées anormales à la lumière (photosensibilité).
Si la perfusion se fait par un cathéter veineux central, le maintien d'une parfaite hygiène de la zone cutanée où il est implanté est primordiale. Ce point constitue une porte d'entrée qui en cas d'infection de la peau aux alentours peut se propager dans le sang entrainant une septicémie.
Votre médecin ou votre infirmière doit vous montrer comment vous devez assurer une parfaite hygiène du cathéter et de la peau qui l'entoure afin d'éviter toute infection. Il est très important que vous suiviez attentivement leurs instructions.
Si l'un des effets indésirables devient grave ou si vous remarquez un effet indésirable non mentionné dans cette notice, parlez-en à votre médecin.
5. COMMENT CONSERVER EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion ?
Tenir hors de la portée et de la vue des enfants.
Ne pas utiliser EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion après la date de péremption mentionnée sur l'étiquette et sur la boîte après la mention EXP. La date de péremption fait référence au dernier jour du mois.
Poudre pour solution pour perfusion:
A conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
Solvant:
Ne pas congeler.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Ne pas utiliser la solution reconstituée si elle présente des particules. La solution tampon de glycine ne contient aucun conservateur: un flacon doit donc être jeté après un usage unique.
Les médicaments ne doivent pas être jetés au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion ?
La substance active est:
l'époprosténol (sous forme d'époprosténol sodique). Chaque flacon contient une quantité d'époprosténol sodique correspondant à 1,5 mg d'époprosténol.
Un ml de solution reconstituée concentrée contient 30 000 ng d'époprosténol (sous forme d'époprosténol sodique).
Les autres composants sont:
Mannitol, glycine, chlorure de sodium, hydroxyde de sodium (servant uniquement à l'ajustement du pH).
Le solvant utilisé pour EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion est composé de chlorure de sodium, de glycine, d'hydroxyde de sodium (servant uniquement à l'ajustement du pH) et d'eau pour préparations injectables.
Forme pharmaceutique et contenu
Qu'est-ce que EPOPROSTENOL SANDOZ 1,5 mg, poudre et solvant pour solution pour perfusion et contenu de l'emballage extérieur ?
Poudre pour solution pour perfusion: Flacon de 15 ml en verre incolore de type I, fermé par un bouchon en caoutchouc et un couvercle en aluminium/propylène.
Solvant: Flacon de 55 ml en verre incolore de type I, fermé par un bouchon en caoutchouc et un couvercle en aluminium/propylène.
Taille des emballages:
La poudre doit être reconstituée et diluée avant la perfusion.
SANDOZ
49 AVENUE GEORGES POMPIDOU
92593 LEVALLOIS-PERRET CEDEX
SANDOZ
49 AVENUE GEORGES POMPIDOU
92593 LEVALLOIS-PERRET CEDEX
LEK PHARMACEUTICALS D.D.
VEROVSKOVA 57
1526 LJUBLJANA
SLOVENIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants:
Conformément à la réglementation en vigueur.
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Afssaps (France).
Informations réservées aux professionnels de santé
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
INSTRUCTIONS SUR LES MODALITES DE RECONSTITUTION, CONSERVATION ET ELIMINATION DE EPOPROSTENOL SANDOZ, poudre et solvant pour solution pour perfusion.
Pour une perfusion intraveineuse au long cours, la solution d'époprosténol sera administrée par un cathéter veineux central à demeure à l'aide d'une pompe pour perfusion continue portable pour usage ambulatoire.
Afin d'éviter d'éventuelles interruptions dans l'administration du médicament en cas de dysfonctionnement accidentel, le patient doit pouvoir avoir accès à une pompe pour perfusion et à un matériel de perfusion de rechange.
La pompe ambulatoire utilisée pour administrer l'époprosténol doit:
Le réservoir doit être en chlorure de polyvinyle, en polypropylène ou en verre.
La préparation de la solution à perfuser et le calcul du débit de perfusion devront être réalisés avec la plus grande attention.
La préparation devra être réalisée en suivant les modalités décrites ci-après.
La reconstitution et la dilution de la solution doivent être réalisées en conditions stériles et immédiatement avant l'administration.
Pour la reconstitution de la solution, la poudre sera diluée uniquement avec la solution tampon de glycine stérile fournie.
Reconstitution:
1. Utiliser uniquement la solution tampon de glycine fournie comme diluant pour reconstituer la solution.
2. Extraire environ 10 ml de solution tampon de glycine dans une seringue stérile, injecter le contenu de la seringue dans le flacon EPOPROSTENOL SANDOZ 1,5 mg, contenant la poudre et agiter doucement jusqu'à sa dissolution.
3. Extraire la solution ainsi produite dans la seringue, puis la réinjecter dans le volume restant de solution tampon de glycine et bien mélanger.
Dilution:
La solution d'époprostenol reconstituée peut être utilisée dans le traitement de l'HTAP soit directement soit sous forme diluée. La solution reconstituée doit être diluée uniquement avec la solution tampon de glycine fournie. Ne pas utiliser une solution de chlorure de sodium pour perfusion (communément désignée sous le terme sérum physiologique) pour la dilution de l'époprosténol utilisé pour le traitement de l'hypertension artérielle pulmonaire.
Les concentrations les plus fréquemment utilisées dans le traitement de l'hypertension artérielle pulmonaire sont les suivantes:
30 000 ng/ml - 1,5 mg d'époprosténol reconstitué dans un volume total de 50 ml de tampon de glycine utilisé comme diluant.
15 000 ng/ml - 1,5 mg d'époprosténol reconstitué et dilué dans un volume total de 100 ml de tampon de glycine utilisé comme diluant.
10 000 ng/ml - 2 flacons de 0,5 mg d'époprosténol reconstitués et dilués dans un volume total de 100 ml de tampon de glycine utilisé comme diluant.
5 000 ng/ml - 1 flacon de 0,5 mg d'époprosténol reconstitué et dilué dans un volume total de 100 ml de tampon de glycine utilisé comme diluant.
La concentration maximale recommandée pour l'utilisation dans le traitement de l'hypertension artérielle pulmonaire est de 60 000 ng/ml.
Etape de filtration:
Une filtration de la solution est nécessaire avant son administration sous forme concentrée ou diluée. Pour réaliser la filtration, extraire le produit reconstitué dans une grande seringue, puis fixer le filtre stérile fourni sur la seringue.
Transférer la solution concentrée directement dans la solution pour perfusion choisie, en exerçant une pression ferme et continue sur le piston; en pratique, il faut environ 70 secondes pour filtrer 50 ml de solution concentrée.
Retirer le filtre de la seringue et la remplir avec le volume de tampon de glycine nécessaire pour obtenir la dilution recherchée.
Fixer de nouveau le filtre sur la seringue, et transférer le tampon supplémentaire à travers le filtre dans la solution concentrée contenue dans la cassette. Bien mélanger.
Le filtre doit être utilisé une seule fois, puis jeté.
Administration
La solution doit être préparée juste avant l'administration et utilisée immédiatement.
Après reconstitution et dilution selon les recommandations mentionnées ci-dessus, la solution pour perfusion d'époprosténol se présente avec un pH d'environ 10 et restera stable pour conserver 90 % de son efficacité pendant environ 12 heures, si elle est maintenue à 25°C.
Aussi, la solution reconstituée ne doit pas être utilisée sur une période de plus de 12 heures lorsqu'elle est administrée à température ambiante (entre 15°C et 25°C). Elle ne doit pas être exposée à des températures dépassant 25°C et doit être maintenue à l'abri de la lumière.
D'un point de vue microbiologique, si la solution reconstituée n'est pas utilisée immédiatement, le respect des conditions de conservation avant son administration sont sous la responsabilité de l'utilisateur et celles-ci ne doivent normalement pas dépasser 24 heures avec des températures de conservations se maintenant entre 2°C et 8°C. Dans ces conditions, la durée maximale de perfusion sera de 8 heures à température ambiante.
Avant utilisation, la solution sera inspectée et jetée en cas de coloration anormale ou s'il existe des particules solides en suspension.
Calcul du débit de perfusion:
Le débit de perfusion Δ(ml/h) sera calculé au moyen de la formule suivante:
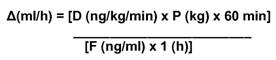
D représente la dose prescrite d'époprosténol exprimée en ng/kg/min.
P représente le poids corporel du patient exprimé en kg.
F représente la concentration d'époprosténol exprimée en ng/ml et calculée sur la base de la formule suivante:
F (ng/ml) = Q (ng)/VD (ml) où VD représente le volume de dilution du solvant exprimé en ml et Q la quantité d'époprosténol exprimée en ng.
Exemples de débits de perfusion:
Débits de perfusion (ml/h) pour une solution d'époprostenol concentrée à 15 000 ng/ml:
|
Concentration = 15 000 ng/ml d'époprosténol |
|||||||||
|
Dosage (ng/kg/min) |
Poids corporel (kg) |
||||||||
|
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
||
|
4 |
1.0 |
1.1 |
1.3 |
1.4 |
1.6 |
||||
|
6 |
1.0 |
1.2 |
1.4 |
1.7 |
1.9 |
2.2 |
2.4 |
||
|
8 |
1.0 |
1.3 |
1.6 |
1.9 |
2.2 |
2.6 |
2.9 |
3.2 |
|
|
10 |
1.2 |
1.6 |
2.0 |
2.4 |
2.8 |
3.2 |
3.6 |
4.0 |
|
|
12 |
1.4 |
1.9 |
2.4 |
2.9 |
3.4 |
3.8 |
4.3 |
4.8 |
|
|
14 |
1.7 |
2.2 |
2.8 |
3.4 |
3.9 |
4.5 |
5.0 |
5.6 |
|
|
16 |
1.9 |
2.6 |
3.2 |
3.8 |
4.5 |
5.1 |
5.8 |
6.4 |
|
Débits de perfusion en ml/h.
Débits de perfusion (ml/h) pour une solution d'époprostenol concentrée à 5 000 ng/ml:
|
Concentration = 5 000 ng/ml d'époprosténol |
|||||||||
|
Dosage (ng/kg/min) |
Poids corporel (kg) |
||||||||
|
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
||
|
2 |
1.0 |
1.2 |
1.4 |
1.7 |
1.9 |
2.2 |
2.4 |
||
|
4 |
1.4 |
1.9 |
2.4 |
2.9 |
3.4 |
3.8 |
4.3 |
4.8 |
|
|
6 |
2.2 |
2.9 |
3.6 |
4.3 |
5.0 |
5.8 |
6.5 |
7.2 |
|
|
8 |
2.9 |
3.8 |
4.8 |
5.8 |
6.7 |
7.7 |
8.6 |
9.6 |
|
|
10 |
3.6 |
4.8 |
6.0 |
7.2 |
8.4 |
9.6 |
10.8 |
12.0 |
|
|
12 |
4.3 |
5.8 |
7.2 |
8.6 |
10.1 |
11.5 |
13.0 |
14.4 |
|
|
14 |
5.0 |
5.7 |
8.4 |
10.1 |
11.8 |
13.4 |
15.1 |
16.8 |
|
|
16 |
5.8 |
7.7 |
9.6 |
11.5 |
13.4 |
15.4 |
17.3 |
19.2 |
|
Débits de perfusion en ml/h.
DUREE DE CONSERVATION DE LA SOLUTION POUR PERFUSION RECONSTITUEE:
Ne pas congeler. Conserver à l'abri de la lumière.
· Conservation/utilisation réfrigérée: La solution reconstituée se conserve 48 heures à une température comprise entre 2°C et 8°C.
· Conservation/utilisation à température ambiante: Administrées à température ambiante (jusqu'à 25°C), les solutions reconstituées peuvent être utilisées pendant 12 heures maximum.
· Conservation réfrigérée, utilisation à température ambiante: Avant utilisation à température ambiante, les solutions reconstituées peuvent être conservées au froid (entre 2°C et 8°C) pendant 40 heures maximum. Dans ce cas, les solutions peuvent être utilisées pendant 8 heures maximum.
Sans objet.
